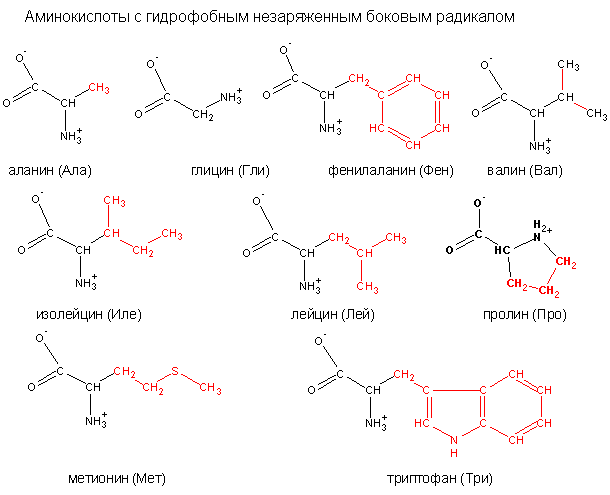
Циклические аминокислоты
Предыдущая1234567891011121314Следующая
Аминокислоты, содержащие в составе молекулы ароматическое (бензольное) или гетероциклическое ядро, называются циклическими.
Ароматические аминокислоты.
Фенилаланин (α-амино-β-фенилпропионовая кислота) впервые обнаружен в гидролизате ростков люпина в 1879 г.
Очень распространенная аминокислота. В большом количестве обнаружена в составе гормона инсулина. Является основным субстратом, из которого образуются гормоны адреналин и тироксин.
Тирозин (α-амино-β-3-параоксифенилпропио-новая кислота) впервые выделен из гидролизата казеина в 1846 г. Входит в состав многих белков. Так же, как и фенилаланин, тирозин является источником биосинтеза гормонов адреналина, норадреналина и тироксина.
Гетероциклические аминокислоты.
Триптофан (α-амино-β-индолилпропионовая кислота) открыт в гидролизате казеина в 1901 г. Входит в состав многих белков в небольшом количестве. В животных тканях не синтезируется. В результате декарбоксилирования триптофана образуется триптамин — регулятор кровяного давления в животном организме:
Гистидин (α -амино-β-имидазолилпропионовая кислота) обнаружен в белках спермы осетра в 1896г., в 1911 г.
Недостаток гистидина в пище приводит к нарушениям мышечной деятельности, синтеза гемоглобина.
Остаток гистидина— имидазольное кольцо — входит в состав активных центров многих ферментов.
Составными частями белков являются также некоторые имино-кислоты, содержащие не аминную (—NH2), а иминную (>NH) группу
Пролин (пирролидин-2-карбоновая кислота) получен из гидролизата казеина в 1901 г.
Обнаружен во всех белках. Особенно богаты пролином коллаген, казеин и белки проламины (до 15 %). Пролин входит в состав инсулина, грамицидина и др. Синтезируется в тканях.
При окислении пролина образуется оксипролин (4-оксипирролидин-2-карбоновая кислота), обнаруженный в гидролизате желатины в 1902 г. Является составной частью коллагена и эластина.
Из двадцати перечисленных аминокислот десять не синтезируются в организме человека и должны поступать вместе с пищей.
Они называются незаменимыми. Содержание в пище остальных аминокислот не обязательно, поскольку организм способен их синтезировать.
Врачи подчеркивают важность α-аминокислот, пептидов и белков для здоровья человека. Эти молекулы играют ключевую роль в строительстве тканей, поддержании иммунной функции и регуляции обмена веществ. Специалисты отмечают, что полноценное питание, содержащее все необходимые аминокислоты, способствует улучшению физического состояния и повышению жизненной энергии. Врачами также акцентируется внимание на том, что дефицит белка может привести к серьезным последствиям, включая ослабление иммунной системы и замедление восстановления после заболеваний. Кроме того, пептиды, как более короткие цепочки аминокислот, становятся все более популярными в медицине и косметологии благодаря своим регенеративным свойствам. Врачи рекомендуют следить за балансом этих веществ в рационе, чтобы поддерживать здоровье и активность на высоком уровне.

Из Дополнительных материалов
При написании последовательности аминокислотных остатков в полипептидной цепи Международный союз теоретической и прикладной химии и Международный биохимический союз предложили пользоваться сокращенными названиями аминокислоты, состоящими обычно из первых трех букв полного названия соответствующей аминокислоты (см. таблицу). Использование интернациональной латинизированной стандартной системы символов и сокращений представляет большие преимущества с точки зрения сбора, обработки и отыскания научной информации, устранения ошибок при переводе текстов с иностранных языков и тому подобное. Унифицированные сокращенные названия химических соединений, в том числе и аминокислот, особенно важны не только в международном отношении, но и для применения внутри СССР, где научная литература издается на десятках языков, различных по алфавиту, лексике и начертанию специальных терминов и их сокращенных обозначений.
Сокращенные обозначения свободных аминокислот не следует употреблять в тексте работ, это допустимо только в таблицах, списках, схемах.
Там, где последовательность аминокислотных остатков в пептидной цепи известна, символы остатков пишут по порядку, соединяя их дефисами; та цепь или часть цепи, где последовательность соединения аминокислотных остатков неизвестна, заключается в круглые скобки, причем символы остатков аминокислоты разделяются запятыми. При написании линейных пептидов или белков на левом конце установленной последовательности (то есть на ее N-конце) ставится символ аминокислоты, несущей свободную аминогруппу, а на правом конце (на C-конце) — символ остатка аминокислоты, несущего свободную карбоксильную группу. Полипептидную цепь предпочтительнее изображать горизонтально, а не вертикально расположенной последовательностью. Символы аминокислоты обозначают природные (L-) формы, их антиподы — символом D-, который ставят непосредственно перед символом аминокислоты, не отделяя от него дефисом (например, Лей-DФен-Гли).
Символы менее распространенных в живой природе аминокислоты особо оговариваются в каждой публикации. Рекомендуется соблюдать лишь следующие принципы, например, гидроксиаминокислоты (оксиаминокислоты): гидроксилизин (оксилизин) — Hyl (Оли) и так далее; алло-аминокислоты: алло-изо лейцин — aile (аИле), алло-оксилизин — aHyl (аОли); нораминокислоты: норвалин —Nva (Нва), норлейцин — Nle (Нле) и т. д.
Таблица. Сокращенное написание символов аминокислот, наиболее распространенных в живой природе
|
Полное название аминокислоты |
Международные символы |
Символы, принятые в русских научных изданиях |
|
Аланин |
Ala |
Ала |
|
Аргинин |
Arg |
Apr |
|
Аспарагин |
Asn |
Асн |
|
Аспарагиновая кислота |
Asp |
Асп |
|
Аспарагиновая кислота и л pi аспарагин (если |
Asx |
Асх |
|
Валин |
Val |
Вал |
|
Гидроксипролин |
Hyp |
Опр |
|
Гистидин |
His |
Г ис |
|
Глицин |
Gly |
Гли |
|
Глутамин |
Gin |
Гли |
|
Глутаминовая кислота |
Glu |
Глу |
|
Глутаминовая кислота или глутамин (если различие не |
Glx |
Глх |
|
Изолейцин |
lie |
Иле |
|
Лейцин |
Leu |
Лей |
|
Лизин |
Lys |
Лиз |
|
Метионин |
Met |
Мет |
|
Пролин |
Pro |
Про |
|
Серин |
Ser |
Сер |
|
Тирозин |
Туг |
Тир |
|
Треонин |
Thr |
T ре |
|
Триптофан |
Trp |
Трп (иногда Три) |
|
Фенилаланин |
Phe |
Фен |
|
Цистеин |
Cys |
Цис |
Классификация аминокислот
Характерные свойства отдельных Аминокислот определяются боковой цепью, то есть радикалом, стоящим у α-углеродного атома. В зависимости от строения этого радикала аминокислоты подразделяют на алифатические (к ним относится большинство аминокислот), ароматические (фенилаланин и тирозин), гетероциклические (гистидин и триптофан) и иминокислоты (см.), у которых атом азота, стоящий при α-углеродном атоме, соединен с боковой цепью в пирролидиновое кольцо; к ним относятся пролин и оксипролин (см. Пролин).
По числу карбоксильных и аминных групп аминокислоты делят следующим образом.
Моноаминомонокарбоновые аминокислоты содержат одну карбоксильную и одну аминную группы; к ним относится большая часть аминокислот (их рI лежит ок. рН 6).
Моноаминодикарбоновые аминокислоты содержат две карбоксильные и одну аминную группы. Аспарагиновая и глутаминовая кислота (см.) обладают слабокислыми свойствами.
Диаминомонокарбоновые кислоты — аргинин (см.), лизин (см.), гистидин (см.) и орнитин — в водном растворе диссоциируют преимущественно как основания.
По химическому составу замещающих групп различают: оксиаминокислоты (содержат спиртовую группу) — серин и треонин (см.), серосодержащие аминокислоты (содержат в своем составе атомы серы) — цистеин, цистин (см.) и метионин (см.); амиды (см.) дикарбоновых аминокислот — аспарагин (см.) и глутамин (см.) и тому подобное Аминокислоты с углеводородным радикалом, например аланин, лейцин, валин и другие, придают белкам гидрофобные свойства; если радикал содержит гидрофильные группы, как, например, у дикарбоновых аминокислот, они сообщают белку гидрофильность.
Помимо уже упомянутых аминокислот (см. таблицу и соответствующие статьи), в тканях человека, животных, растений и у микроорганизмов найдено еще более 100 аминокислот, многие из которых играют важную роль в живых организмах. Так, орнитин и цитруллин (относятся к диаминокарбоновым аминокислотам) играют важную роль в обмене веществ, в частности в синтезе мочевины у животных (см. Аргинин, Мочевина). В организмах найдены высшие аналоги глутаминовой кислоты: α-аминоадипиновая кислота с б атомами углерода и α-аминопимелиновая кислота с 7 атомами углерода. В составе коллагена и желатина найден оксилизин:
имеющий два асимметрических атома углерода. Из алифатических моноаминомонокарбоновых аминокислот встречаются α-аминомасляная кислота, норвалин (α-аминовалериановая кислота) и норлейцин (α-ампнокапроновая кислота). Последние две получены синтетически, но не встречаются в составе белков. Гомосерин (α-амино-γ-оксимасляная кислота) является высшим аналогом серина. Соответственно α-амино-γ-тиомасляная кислота, или гомоцистеин, является подобным аналогом цистеина. Две последние аминокислоты наряду с лантионином:
и цистатионином:
принимают участие в обмене серосодержащих аминокислот 2,4-Диоксифенилаланин (ДОФА) является промежуточным продуктом обмена фенилаланина (см.) и тирозина (см.). Из тирозина образуется такая аминокислота, как 3,5-дийодтирозин — промежуточный продукт образования тироксина (см.). В свободном состоянии и в составе некоторых природных веществ встречаются аминокислоты, метилированные (см. Метилирование) по азоту: метилглицин, или саркозин [CH2(NHCH3) COOH], а также метилгистидин, метилтриптофан, метиллизин. Последний недавно обнаружен в составе ядерных белков — гистонов (см.). Описаны также ацетилированные производные аминокислот, в том числе ацетиллизин составе гистонов.
Помимо α-аминокислот в природе, главным образом в свободном виде и в составе некоторых биологически важных пептидов, встречаются Аминокислот, содержащие аминогруппу у других атомов углерода. К ним относятся β-аланин (см. Аланин), γ-аминомасляная кислота (см. Аминомасляные кислоты), играющая важную роль в функционировании нервной системы, δ-аминолевулиновая кислота, являющаяся промежуточным продуктом синтеза порфиринов. К аминокислотам относят также таурин (H2N—CH2—CH2—SO3H), образующийся в организме в процессе обмена цистеина.
Глава 12 о α-аминокислотах, пептидах и белках вызывает живой интерес у студентов и специалистов в области биохимии. Многие отмечают, что материал представлен доступно и логично, что облегчает понимание сложных концепций. Читатели подчеркивают важность α-аминокислот как строительных блоков белков и их роли в метаболизме. Пояснения о синтезе пептидов и структуре белков вызывают положительные отзывы, так как помогают связать теорию с практическими аспектами. Некоторые отмечают, что примеры из реальной жизни делают информацию более актуальной и запоминающейся. В целом, глава воспринимается как полезный ресурс для углубленного изучения темы.
Библиография
Браунштейн А. Е. Биохимия аминокислотного обмена, М., 1949, библиогр.; Майстер А. Биохимия аминокислот, пер. с англ., М., 1961; Greenstein J. P. a. Winitz M. Chemistry of the amino acids, v. 1—3, N. Y.—L., 1961; Meister A. Biochemistry of the amino acids, v. 1—2, N. Y., 1965; Nivard R. J. Е. а. Тesser G. I. Amino acids and related compounds, Comprehens. Biochem., v. 6, p. 143, 1965, bibliogr.; Номенклатура биологической химии, пер. с англ., под ред. А. Е. Браунштейна, в. 1, с. 13 и др., М., 1968.
Гистохимические методы выявления Аминокислот в тканях
Лилли Р. Патогистологическая техника и практическая гистохимия, пер. с англ., М., 1969, библиогр.; Пирс Э. Гистохимия, пер. с англ., с. 73, М., 1962; Принципы и методы гистоцитохимического анализа и патологии, под ред. А. П. Авцына и др., Л., 1971, библиогр.

Оптические свойства
Все α-аминокислоты, за исключением глицина (см.), имеют асимметрический атом углерода. Таким атомом всегда является 2-й, или α-углеродный, атом, все четыре валентности которого заняты различными группами. В этом случае возможны две стереоизомерные формы, являющиеся зеркальным отражением друг друга и несовместимые между собой подобно правой и левой руке. На схеме изображены два стереоизомера аминокислоты аланина в виде объемного изображения и соответствующей ему проекции на плоскости. Изображение слева условно принято считать левой конфигурацией (L), справа — правой конфигурацией (D). Такие конфигурации соответствуют лево- и правовращающему глицериновому альдегиду, который принят за исходное соединение при определении конфигурации молекул. Показано, что все природные аминокислоты, получаемые из гидролизатов белков, по конфигурации α-углеродного атома соответствуют L-ряду, то есть могут рассматриваться как производные L-аланина, в котором один водородный атом в метальной группе заменен на более сложный радикал. Удельное вращение плоскости поляризации света отдельных Аминокислот зависит как от свойств всей молекулы в целом, так и рН-раствора, температуры и других факторов.
Удельное вращение важнейших аминокислот, их изоэлектрические точки и показатели констант кислотной диссоциации (рКа) представлены в табл. 2.
| Аминокислота | Удельное вращение | Константы кислотной диссоциации | Изоэлектрическая точка рI | |||
|---|---|---|---|---|---|---|
| водного раствора | в 5 н. растворе соляной кислоты | pK1 | pK2 | pK3 | ||
| Алании | +1,6 | +13,0 | 2,34 | 9,69 | 6,0 | |
| Аргинин | +21,8 | +48,1 | 2,18 | 9,09 | 13,2 | 10,9 |
| Аспарагин | -7,4 | +37,8 | 2,02 | 8,80 | 5,4 | |
| Аспарагиновая кислота | +6,7 | +33,8 | 1,88 | 3,65 | 9,60 | 2,8 |
| Валии | +6,6 | 33,1 | 2,32 | 9,62 | 6,0 | |
| Гистидин | +59,8 | +18,3 | 1,78 | 5,97 | 8,97 | 7,6 |
| Глицин | 2,34 | 9,60 | 6,0 | |||
| Глутамин | +9,2 | +46,5 | 2,17 | 9,13 | 5,7 | |
| Глутаминовая кислота | +17,7 | +46,8 | 2,19 | 4,25 | 9,67 | 3,2 |
| Изолейцин | +16,3 | +51,8 | 2,26 | 9,62 | 5,9 | |
| Лейцин | -14,4 | +21,0 | 2,36 | 9,60 | 6,0 | |
| Лизин | +19,7 | +37,9 | 2,20 | 8,90 | 10,28 | 9,7 |
| Метионин | -14,9 | +34,6 | 2,28 | 9,21 | 5,7 | |
| Оксипролин | -99,6 | -66,2 | 1,82 | 9,65 | 5,8 | |
| Пролин | -99,2 | -69,5 | 1,99 | 10,60 | 6,3 | |
| Серии | -7,9 | +15,9 | 2,21 | 9,15 | 5,7 | |
| Тирозин | -6,6 | -18,1 | 2,20 | 9,11 | 10,07 | 5,7 |
| Треонин | -33,9 | -17,9 | 2,15 | 9,12 | 5,6 | |
| Триптофан | -68,8 | +5,7 | 2,38 | 9,39 | 5,9 | |
| Фенилаланин | -57,0 | -7,4 | 1,83 | 9,13 | 5,5 | |
| Цистеин | -20,0 | +7,9 | 1,71 | 8,33 | 10,78 | 5,0 |
| Цистин | 2,01 | 8,02 pK4 = 8,71 | 5,0 |
Раньше оптические антиподы L-аминокислот, то есть аминокислоты D-ряда, называли «неприродными», однако в наст, время аминокислоты D-ряда обнаружены в составе некоторых бактериальных продуктов и антибиотиков. Так, капсулы спороносных бактерий (Вас. subtilis, В. anthracis и другое) в значительной мере состоят из полипептида, построенного из остатков D-глутаминовой кислоты. D-аланин и D-глутамидовая кислота входят в состав мукопептидов, образующих клеточные стенки ряда бактерий; валин, фенилаланин, орнитин и лейцин D-ряда содержатся в составе грамицидинов и многих других пептидов — антибиотиков и тому подобное Стереоизомерные аминокислоты существенно различаются по своим биологическим свойствам, они атакуются ферментами, специфическими только к определенной оптической конфигурации, не заменяют или лишь частично заменяют друг друга в обмене веществ и тому подобное D-изомеры аланина (см.), лейцина (см.), серина (см.), триптофана (см.) и валина (см.) очень сладкие, тогда как L-стереоизомеры аланина и серина умеренно сладкие, триптофана — безвкусны, а лейцина и валина — горьковаты. Характерный «мясной» вкус L-глутаминовой к-ты отсутствует у D-формы. Синтетические аминокислоты обычно представляют собой рацематы, то есть смесь равных количеств D- и L-форм. Их обозначают как DL-аминокислоты. При помощи некоторых специальных реактивов или обработки некоторыми ферментами синтетические аминокислоты можно разделить на D- и L-формы или получить только один желаемый стереоизомер.
Моноаминомонокарбоновая кислота
Теория Сено и Ямабе носит более общий характер, поскольку рассматривает не только сорбцию моноаминомонокарбоновых кислот на катионитах, но и сорбцию других групп аминокислот как на катионитах, так и на анионитах.
Химический состав их хотя и различен, но все же в них следует отметить преобладание моноаминомонокарбоновых кислот, и притом в большом количестве. Для кератинов характерно большое содержание цистина, не встречающегося в таком количестве ни в каком-либо другом белке.
Постоянство коэффициентов активности в фазе ионита для резинатов наблюдается на обычных, стандартных синтетических полимерных сульфокатионитах с простейшими моноаминомонокарбоновыми кислотами в качестве противоионов.
Для таких ионитов и противоионов с использованием разбавленных растворов ( ух и у2 постоянны) можно оценить коэффициенты активности fi и у2 также как постоянные.
Ориентировку в хроматограммах, полученных при применении различных двумерных систем растворителей, мы облегчим, если соединим положения алифатических моноаминомонокарбоновых кислот линией.
Добавление кислот или оснований сильно сказывается на величинах RF для дикарбоновых и основных аминокислот и мало сказывается на движении моноаминомонокарбоновых кислот.
Эти изменения связаны с изменением степени диссоциации указанных аминокислот.
В то время как из метилового эфира свободной аминокислоты и из эфиров дипептидов предпочтительно образуются дикетопиперазины, некоторые эфиры трипептидов моноаминомонокарбоновых кислот обнаруживают ярко выраженную склонность к поликонденсации.
Дан обзор теоретических представлений о механизме сорбции аминокислот на ионитах.
Рассмотрена теория сорбции моноаминомонокарбоновых кислот на катионитах в Н — форме, диаминомонокарбоновых кислот на катионитах в Н — форме и анионите в ОН-форме, моноамино-дикарбоновых кислот на катионитах в Н — форме, и анионитах в ОН-форме. Приведены соответствующие уравнения изотерм сорбции.
Таким путем отделяют растворимые в указанных спиртах моноаминомонокарбоновые кислоты и пролин от дикарбоновых кислот и гексоновых оснований.
Химические свойства аминокислот обусловлены количеством и взаиморасположением входящих в их состав функциональных групп. Например, в результате взаимного погашения свойств карбоксильных и аминных групп моноаминомонокарбоновые кислоты — вещества практически нейтральные. Но поскольку в реакциях эти кислоты могут проявлять и кислотные, и основные свойства, они являются амфотерными электролитами.
Экспериментальные исследования изотерм сорбции аминокислот Н — формой сульфокатионитов, выполненные нами, полностью подтвердили справедливость приведенных выше уравнений. В работе были использованы следующие аминокислоты: глицин, 6-аминопенициллановая кислота ( 6 — АПК) и моноамид аспарагиновой кислоты ( аспарагин), который в этих условиях ведет себя как моноаминомонокарбоновая кислота.
Связи между этими параллельными слоями осуществляются через остатки R аминокислот. Между этими остатками могут существовать в принципе силы электростатического притяжения между группами С00 — и NHjJ, водородные связи между спиртовыми и фенолышми НО группами оксиаминокислот и вандерваальсовы связи между неполярными цепями R моноаминомонокарбоновых кислот.
Все эти силы, несомненно, способствуют устойчивости волокна.
В зависимости от наличия циклов в молекулах аминокислот все аминокислоты делят на ациклические, или алифатические, и циклические. В зависимости от числа амин-ных и карбоксильных групп в молекуле ациклические аминокислоты делятся на три группы: 1) моноаминомонокарбо-новые кислоты, 2) моноаминодикарбоновые кислоты и 3) диам и н омонокарбоновые кислоты.
Электрохимические свойства
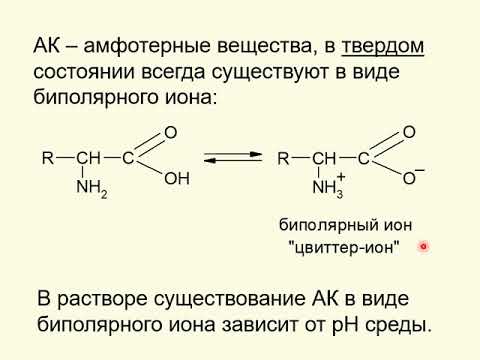
Обладая амфотерными свойствами (см. Амфолиты), аминокислоты в растворах диссоциируют как по типу кислотной диссоциации (отдавая ион водорода и заряжаясь при этом отрицательно), так и по типу щелочной диссоциации (присоединяя Н-ион и освобождая ион гидроксила), приобретая при этом положительный заряд. В кислой среде усиливается щелочная диссоциация аминокилот и происходит образование солей с анионами кислот. В щелочной среде, наоборот, аминокислоты ведут себя как анионы, образуя соли с основаниями. Установлено, что Аминокислоты в растворах практически полностью диссоциируют и находятся в виде амфотерных (биполярных) ионов, называемых также цвиттерионами или амфиионами:
В кислой среде амфотерный ион присоединяет ион водорода, подавляющий кислотную диссоциацию, и превращается в катион; в щелочной среде с присоединением иона гидроксила подавляется щелочная диссоциация, и биполярный ион становится анионом. При определенном значении рН среды, неодинаковом для разных аминокислот, степень кислотной и щелочной диссоциации для данной аминокилоты уравнивается, и в электрическом поле аминокислот не движется ни к катоду, ни к аноду. Это значение рН называют изоэлектрической точкой (pI), которая тем ниже, чем больше у данной аминокилоты выражены кислотные свойства, и тем выше, чем у аминокислоты больше выражены основные свойства (см. Изоэлектрическая точка). При рI растворимость аминокислоты становится минимальной, в соответствии с чем ее легче осадить из раствора.
Аминокислоты Образование внутренних солей (биполярных ионов)
В водных растворах аминокислоты существуют в виде равновесных смесей молекул и биполярных ионов, которые в кислой среде переходят в катионную форму, а в щелочной среде — в анионную форму.
При образовании внутренних солей моноаминомонокарбоновых кислот характер среды не изменяется.
Поэтому эти аминокислоты называются нейтральными. внутренних солей таких кислот
При добавлении кислоты (Н+) карбоксилат-ион протонируется и остается только положительный заряд на группе -NH
При образовании внутренних солей моноаминодикарбоновых кислот образуется избыток ионов водорода, поэтому водные растворы этих кислот имеют рН
внутренних солей кислых аминокислот
При образовании внутренних солей диаминомонокарбоновых кислот образуется избыток гидроксид-ионов, поэтому их водные растворы имеют рН > 7.
Такие аминокислоты называются основными. внутренних солей основных аминокислот
4. Образование пептидов
При взаимодействии карбоксильной группы одной молекулы аминокислоты и аминогруппы другой молекулы аминокислоты образуются
При взаимодействии двух разных аминокислот образуется смесь четырех дипептидов; например:
Дипептид, присоединяя еще одну молекулу аминокислоты, может образовать .
Аналогично из трипептида можно получить и т. д.
5. Образование производных по карбоксильной группе
Как и карбоновые кислоты, аминокислоты могут образовывать сложные эфиры, хлорангидриды и др. Например:
Способы получения
Добро пожаловать
Эта реакция на аминокислоту гистидин основана на взаимодействии гистидина с диазобензолсульфоновой кислотой с образованием соединения вишнево-красного цвета.
Реакцию диазотирования осуществляют при взаимодействии кислого раствора сульфаниловой кислоты с нитритом натрия. При этом образуется диазобензолсульфоновая кислота:
Эта кислота, взаимодействуя с гистидином, дает соединение вишнево-красного цвета:
Описание опыта.
В пробирку наливают 1 мл 1%-го раствора сульфаниловой кислоты в 5%-м растворе соляной кислоты. Затем прибавляют 2 мл 0,5%-го раствора нитрита натрия, сильно встряхивают и немедленно приливают 2 мл 0,01%-го раствора гистидина. После перемешивания содержимого пробирки сразу приливают 6 мл 10%-го раствора соды.
Появляется интенсивная вишнево-красная окраска.
Дата добавления: 2015-07-21; просмотров: 603; Опубликованный материал нарушает авторские права?
| Защита персональных данных |
Не нашли то, что искали? Воспользуйтесь поиском:
Применение аминокислот
Аминокислоты находят широкое применение в медицине и других областях. Различные наборы аминокислоты и гидролизаты белков, обогащенные отдельными аминокислотами, применяются для парентерального питания при операциях, заболеваниях кишечника и нарушениях всасывания. Некоторые аминокислоты оказывают специфический терапевтический эффект при различных расстройствах. Так, метионин применяют при ожирении печени, циррозах и тому подобное; глутаминовая и γ-амино-масляная кислоты дают хороший эффект при некоторых заболеваниях центральной нервной системы (эпилепсии, реактивных состояниях и так далее); гистидин иногда применяют для лечения больных гепатитами, язвенной болезнью желудка и двенадцатиперстной кишки.
Аминокислоты применяют также в качестве добавок к пищевым продуктам. Практически наиболее важны добавки лизина, триптофана и метионина к пищевым продуктам, неполноценным по содержанию этих аминокислот. Добавка глутаминовой к-ты и ее солей к ряду продуктов придает им приятный мясной вкус, что часто используют в кулинарии. Помимо питания человека и применения аминокислоты в пищевой промышленности, их используют для кормления животных, для приготовления культуральных сред в микробиологической промышленности и как реактивы.
См. также Азотистый обмен, Обмен веществ и энергии, Окисление биологическое.
Гистохимические методы выявления аминокислот в тканях
Реакции выявления аминокислоты в тканях основаны главным образом на выявлении аминогрупп (NH2-), карбоксильных (СООН—), сульфгидрильных (SH-) и дисульфидных (SS-) групп. Разработаны методы выявления отдельных аминокислот (тирозина, триптофана, гистидина, аргинина). Идентификация аминокислоты проводится также при помощи блокирования тех или иных групп. Следует иметь в виду, что гистохимик имеет дело, как правило, с денатурированным белком, поэтому результаты гистохимических методов не всегда сопоставимы с биохимическими.
Для выявления SH- и SS-групп лучшей считается реакция с 2,2′-диокси — 6,6′ — динафтилдисульфидом (ДДД), основанная на образовании нафтил дисульфид а, связанного с белком, содержащим SH-группы. Для развития окраски препарат обрабатывают солью диазония (прочный синий Б или прочный черный К), которая соединяется с нафтилдисульфидом, образуя азокраситель, окрашивающий участки локализации SH-и SS-групп в тканях в оттенки от розового до сине-фиолетового. Метод позволяет проводить количественные сопоставления. Ткань фиксируется в жидкости Карнуа, Буэна, в формалине. Лучшие результаты дает 24-часовая фиксация в 1% растворе трихлоруксусной кислоты на 80% спирте с последующей промывкой в серии спиртов возрастающей концентрации (80, 90, 96%), затем производится обезвоживание и заливка в парафин. Для реакции необходимы реактивы: ДДД, соль диазония, 0,1 М веронал-ацетатный буферный раствор (рН 8,5), 0,1 М фосфатный буферный раствор (рН 7,4), этиловый спирт, серный эфир.
α-Аминокислоты выявляются с помощью нингидрин-реактива Шиффа. Метод основан на взаимодействии нингидрина с аминогруппами (NH2-); образующийся при этом альдегид выявляется реактивом Шиффа. Материал фиксируется в формалине, безводном спирте, жидкости Ценкера, заключается в парафин. Необходимы реактивы: нингидрин, реактив Шиффа, этиловый спирт. Ткани, содержащие α-аминогруппы, окрашиваются в розовато-малиновые оттенки. Специфичность реакции, однако, является спорной, так к окислению нингидрином могут подвергаться не только α-аминокислоты, но и другие алифатические амины.
Тирозин, триптофан, гистидин выявляются тетразониевым методом. Соли диазония в щелочной среде находятся в виде гидроксидов диазония, присоединяющихся к названным аминокислотам. Для усиления цветной окраски срезы обрабатывают β-нафтолом или Н-кислотой. Фиксация формалином, жидкостью Карнуа. Необходимые реактивы: тетразотированный бензидин или лучше прочный синий Б, 0,1 М вероналацетатный буферный раствор (рН 9,2); 0,1 н. HCl, Н-кислота или β-нафтол. В зависимости от реактива срезы окрашиваются в фиолетово-синий или коричневый цвет. При оценке результатов нужно иметь в виду возможность присоединения к гидроксиду диазония фенола и ароматических аминов. Для дифференцировки аминокислот применяют контрольные реакции.
Вопрос-ответ
Какие аминокислоты входят в состав природных белков и пептидов?
Кислота, глутаминовая кислота, аспарагин, глутамин, – незаменимые (не могут синтезироваться в организме и должны поступать с пищей), их 8: валин, лейцин, изолейцин, треонин, лизин, метионин, фенилаланин, триптофан, – полузаменимые (синтезируются в организме, но в недостаточном количест- ве): аргинин и гистидин.
Какова связь между аминокислотами, пептидами и белками?
Молекула белка состоит из длинной цепочки этих аминокислот, каждая из которых связана со своей соседкой ковалентной пептидной связью (рисунок 3-1). Поэтому белки также известны как полипептиды. Каждый тип белка имеет уникальную последовательность аминокислот, абсолютно одинаковую от одной молекулы к другой.
Что такое пептиды и аминокислоты?
Пептиды представляют собой короткие цепочки аминокислот. Аминокислоты являются основными строительными блоками белков и других различных типов органических молекул. Пептиды отличаются от белков тем, что они намного короче и не имеют такого же типа вторичных складчатых структур.
Что такое белки и пептиды?
Белки и пептиды идентичны по своей химической природе и отличаются только длинной аминокислотной цепи: более 50 аминокислот – белок, менее 50 аминокислот – пептид.
Советы
СОВЕТ №1
Изучите основные функции α-аминокислот в организме. Понимание их роли в синтезе белков, метаболизме и других биохимических процессах поможет вам лучше осознать важность этих молекул для здоровья и физического состояния.
СОВЕТ №2
Обратите внимание на источники белка в вашем рационе. Включение разнообразных источников, таких как мясо, рыба, яйца, бобовые и орехи, обеспечит поступление всех необходимых аминокислот, включая незаменимые.
СОВЕТ №3
Изучите влияние пептидов на здоровье. Пептиды, состоящие из коротких цепочек аминокислот, могут иметь различные биологические эффекты, включая улучшение иммунной функции и ускорение восстановления после тренировок.
СОВЕТ №4
Не забывайте о значении белков в спортивном питании. Если вы занимаетесь спортом, важно правильно рассчитывать потребление белка для оптимизации восстановления и роста мышечной массы. Консультация с диетологом может помочь вам в этом.